- O Adbry é o primeiro produto biológico lançado pela LEO Pharma nos Estados Unidos e deve estar disponível nas farmácias em fevereiro de 2022.
- O tralocinumab é comercializado fora dos Estados Unidos sob o nome comercial Adtralza® e atualmente é aprovado na União Europeia, Grã-Bretanha, Canadá e Emirados Árabes Unidos.
BALLERUP, Dinamarca, December 29, 2021–(BUSINESS WIRE)–A LEO Pharma A/S, líder global em dermatologia médica, anunciou hoje que a Food and Drug Administration (FDA) dos EUA aprovou o Adbry™(tralocinumab) para tratamento da dermatite atópica moderada a grave em adultos com 18 anos ou mais, nos casos em que a doença não é controlada de maneira adequada com terapias de prescrição tópicas ou quando essas terapias não são aconselháveis. O Adbry pode ser usado com ou sem corticosteroides tópicos.1 O Adbry é o primeiro e único produto biológico aprovado pela FDA que se liga especificamente e inibe a citocina IL-13, um dos principais estimuladores dos sinais e sintomas da dermatite atópica.1,2,3
“A aprovação do Adbry pela FDA hoje é um marco importante para a LEO Pharma e para os milhões de pessoas que vivem com a dermatite atópica moderada a grave que buscam uma opção de tratamento adequada para essa doença crônica e debilitante”, disse Anders Kronborg, Diretor Financeiro e CEO em Exercício da LEO Pharma A/S. “Como nosso primeiro produto biológico nos Estados Unidos, o Adbry representa um progresso importante em nossa missão de promover o avanço do padrão de tratamento na área da dermatologia médica.”
A aprovação do Adbry é baseada nos resultados de segurança e eficácia dos ensaios principais de fase 3 ECZTRA 1, 2 e ECZTRA 3, que incluíram quase 2.000 pacientes adultos com dermatite atópica moderada a grave.1 Os dados de segurança foram avaliados a partir de um grupo de cinco ensaios clínicos randomizados, duplo-cegos, controlados por placebo, incluindo ECZTRA 1, 2 e ECZTRA 3, um ensaio de determinação de dose e um ensaio de resposta vacinal.1
“A dermatite atópica pode ser severa e imprevisível, o que dificulta o controle da doença em longo prazo e o próprio tratamento médico, uma vez que existem opções de tratamento limitadas para essa doença de pele crônica complicada”, disse Jonathan Silverberg, médico, PhD, mestre em saúde pública, professor associado de dermatologia na Escola de Medicina e Ciências da Saúde da George Washington University e pesquisador do ensaio clínico do tralocinumab. “O Adbry será um acréscimo importante ao nosso arsenal terapêutico, um tratamento projetado para atingir e neutralizar especificamente a citocina IL-13, ajudando os pacientes a controlar a dermatite atópica”.
O Adbry estará disponível em seringas pré-carregadas de 150 mg/mL para injeção subcutânea, com dose inicial de 600 mg, seguida de 300 mg em semanas alternadas. O Adbry pode ser usado com ou sem TCS.1 Uma dosagem de 300 mg a cada quatro semanas pode ser considerada para pacientes com menos de 100 kg que alcançarem uma pele limpa ou quase limpa após 16 semanas de tratamento.1
Para ajudar os pacientes elegíveis a terem acesso ao Adbry, a LEO Pharma apresentará o programa AdbryTM AdvocateTM para apoiar os pacientes dos EUA no diagnóstico e no tratamento com o Adbry.
“Para pessoas que convivem com a dermatite atópica, a experiência vai além da pele, muitas vezes impactando aspectos psicossociais importantes de suas vidas”, disse Julie Block, presidente e CEO da National Eczema Association. “É animador ver uma nova opção terapêutica direcionada para pacientes adultos que vivem com dermatite atópica moderada a grave. Avanços terapêuticos como este dão a esperança necessária para aqueles que passaram anos em busca de uma terapia adequada para aliviar essa doença.”
A aprovação do FDA marca a quinta aprovação regulatória global do tralocinumab em 2021. O tralocinumab é comercializado fora dos Estados Unidos sob o nome comercial Adtralza® e atualmente é aprovado na União Europeia, Grã-Bretanha, Canadá e Emirados Árabes Unidos.
Sobre os ensaios principais ECZTRA 1, 2 e ECZTRA 3
ECZTRA 1 e ECZTRA 2 (ensaios ECZema TRAlokinumab n.º 1 e 2) foram ensaios randomizados, duplo-cegos, controlados por placebo, multinacionais de 52 semanas que incluíram 802 e 794 pacientes adultos, respectivamente, para avaliar a eficácia e segurança do Adbry (300 mg em semanas alternadas) como monoterapia em adultos com dermatite atópica moderada a grave que eram candidatos à terapia sistêmica.4
ECZTRA 3 (ensaio ECZema TRAlokinumab n.º 3) foi um ensaio duplo-cego, randomizado, controlado por placebo, multinacional de 32 semanas que incluiu 380 pacientes adultos para avaliar a eficácia e segurança do Adbry (300 mg a cada duas semanas) em combinação com TCS, conforme necessário, em adultos com dermatite atópica moderada a grave que eram candidatos à terapia sistêmica.5
Sobre a dermatite atópica
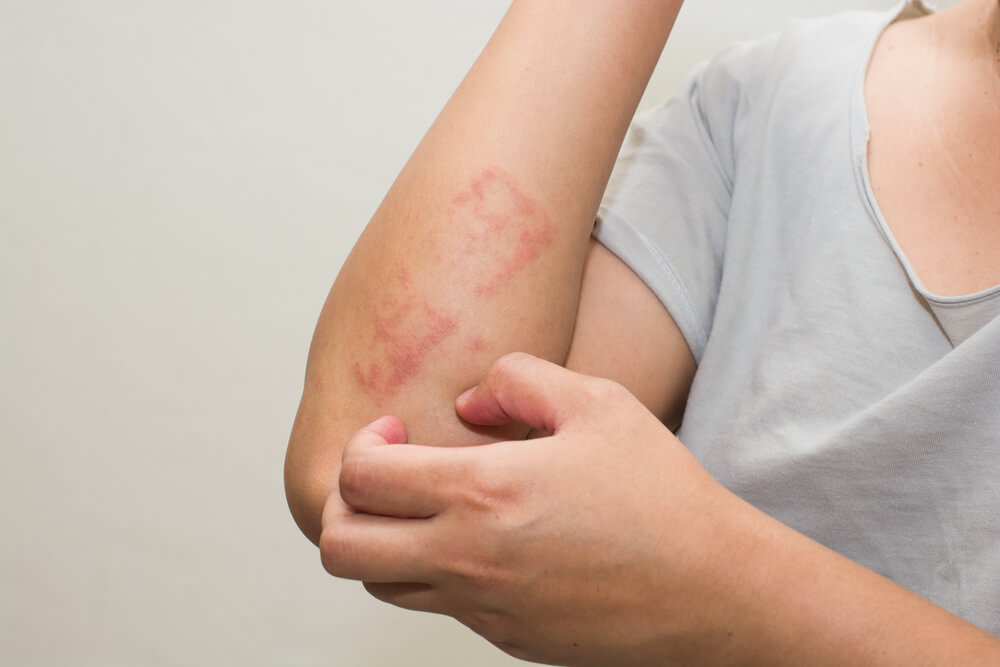
A dermatite atópica é uma doença de pele crônica e inflamatória, caracterizada por coceira intensa e lesões eczematosas.6 A dermatite atópica é o resultado da disfunção da barreira cutânea e da desregulação imunológica, levando à inflamação crônica.7 As citocinas do tipo 2, incluindo a IL-13, desempenham um papel central nos principais aspectos da fisiopatologia da dermatite atópica.2
Sobre o Adbry™(tralocinumab)
O Adbry (tralocinumab) é um anticorpo monoclonal humano desenvolvido para neutralizar especificamente a citocina IL-13, que desempenha um papel fundamental nos processos imunológicos e inflamatórios subjacentes aos sinais e sintomas da dermatite atópica. O Adbry se liga especificamente à citocina IL-13, inibindo a interação com as subunidades α1 e α2 do receptor de IL-13 (IL-13Rα1 e IL-13Rα2).2,3
Sobre a LEO Pharma
A LEO Pharma ajuda as pessoas a terem uma pele saudável. A empresa é líder em dermatologia médica, com um setor de P&D avançado, uma ampla variedade de terapias e um espírito pioneiro. Fundada em 1908 e de propriedade majoritária da LEO Foundation, a LEO Pharma dedicou décadas de pesquisa e desenvolvimento para promover o avanço da ciência dermatológica, definindo novos padrões de tratamento para pessoas com doenças de pele. A LEO Pharma tem sede na Dinamarca, com uma equipe global de 6.000 pessoas, atendendo 93 milhões de pacientes em 130 países. Em 2020, a empresa gerou DKK 10,133 milhões em vendas líquidas. Para obter mais informações, acesse www.LEO-Pharma.com.
Fonte:Yahoo Esportes