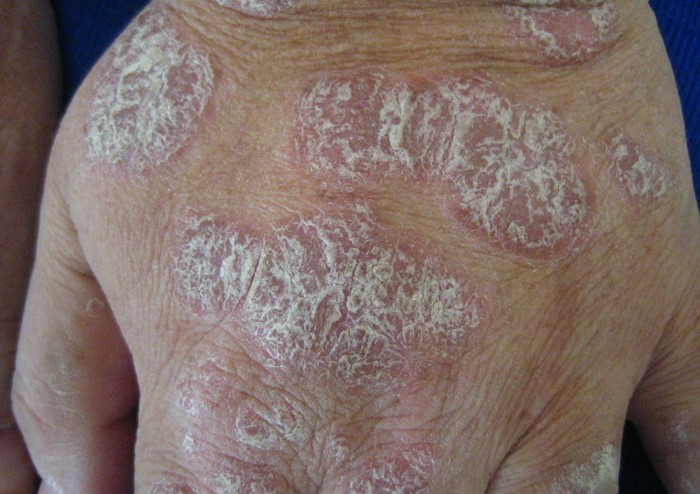
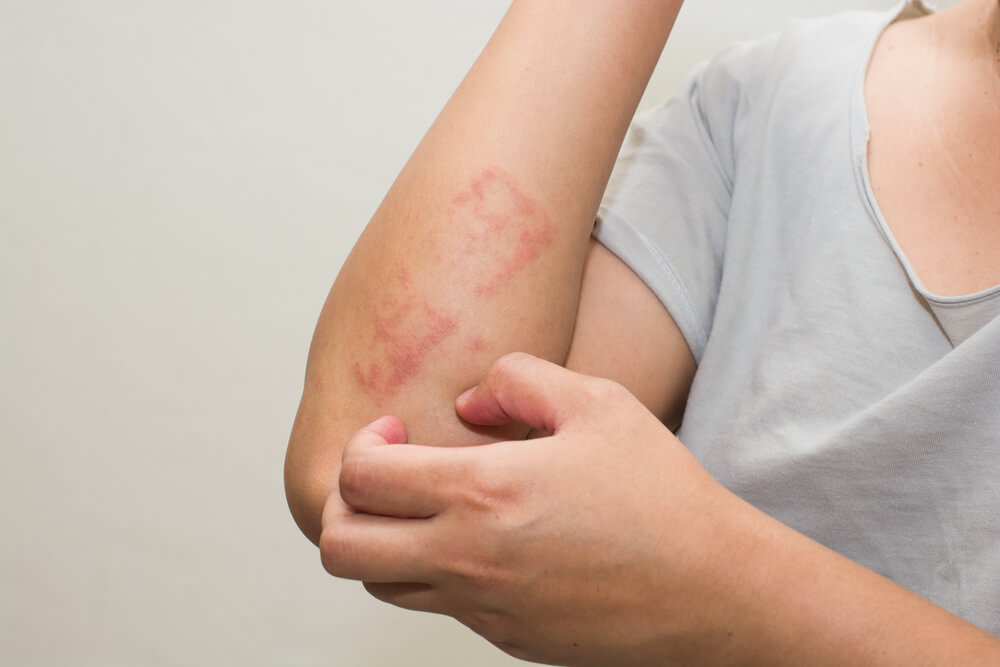
APREMILAST foi aprovado para a gravidade da psoríase leve e moderada.
Em 21 de dezembro de 2021, a Food and Drug Administration (FDA) dos Estados Unidos estendeu a aprovação do Otezla® (apremilast) para o tratamento de pacientes adultos com psoríase em placas que são candidatos à fototerapia ou terapia sistêmica, agora incluindo aqueles indivíduos com tratamento leve ou gravidade moderada da psoríase em placas.
OTEZLA® é um medicamento oral que atua inibindo a fosfodiesterase 4 específica para o monofosfato de adenosina cíclico (cAMP). Com esta indicação expandida, Otezla® é agora o primeiro (e único) tratamento oral aprovado em pacientes adultos em todas as gravidades de psoríase.
Esta aprovação expandida é baseada nos resultados do estudo de Fase 3 ADVANCE, que descobriu que 5 vezes mais adultos com psoríase em placas leve a moderada obtiveram uma resposta de Avaliação Global do Médico Estático (sPGA) (definida como uma pontuação sPGA de claro [0] ou quase claro [1] com pelo menos uma redução de 2 pontos da linha de base) na semana 16 em comparação com o placebo. Além disso, foram observadas melhorias na resposta da escala de avaliação numérica de coceira de corpo inteiro e na avaliação global de médicos de couro cabeludo.
Anteriormente, Otezla® foi aprovado para psoríase em placas moderada a grave, artrite psoriática ativa e para úlceras orais associadas à doença de Behçet.