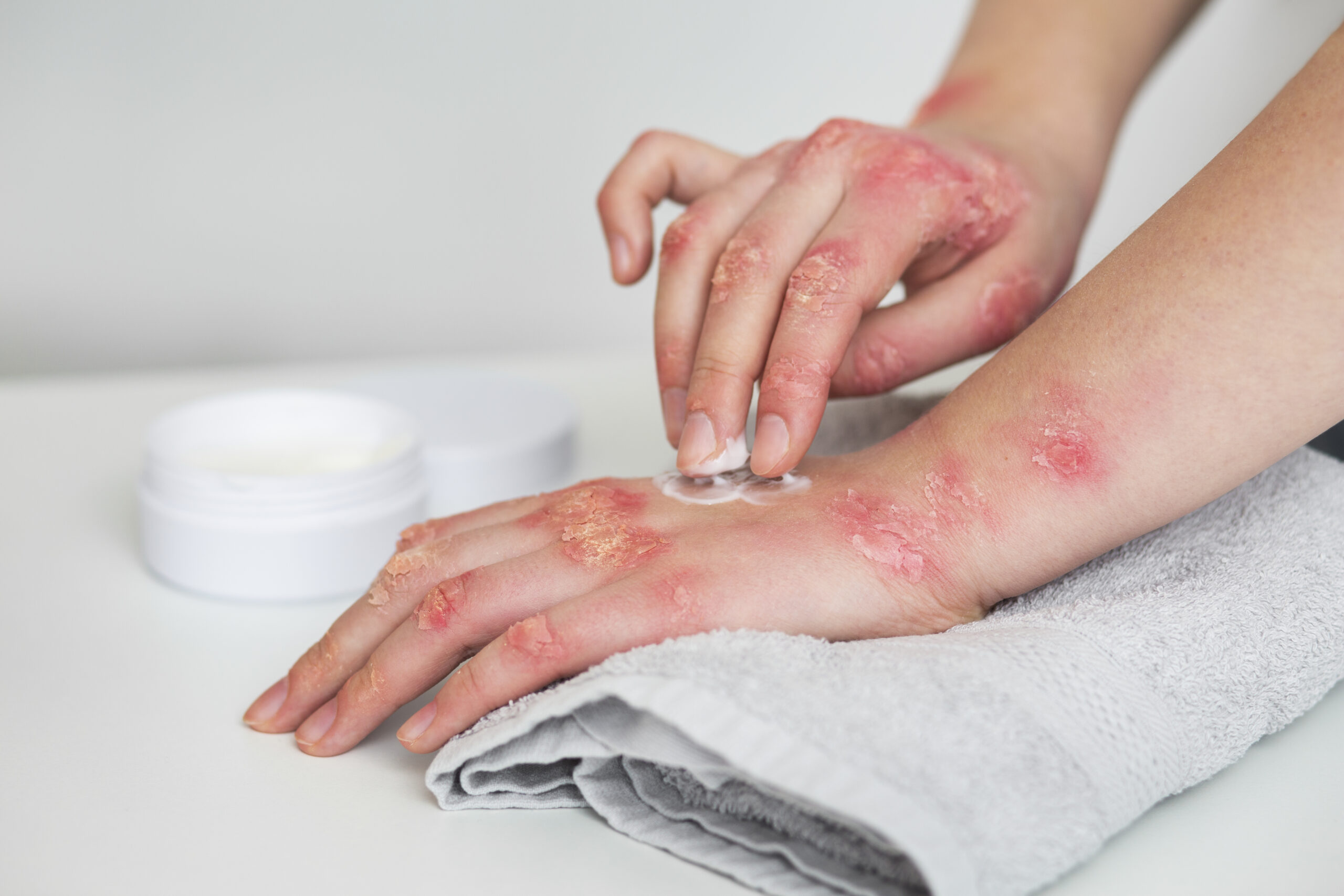
Entre as vantagens desse tipo de medicamento estão a entrega de respostas clínicas seguras e a ampliação do acesso a diversos tipos de tratamento
O Brasil já conta com o registro de 32 biossimilares, usados no tratamento de diversas doenças. Todos passaram por rigorosos ensaios e estudos clínicos, para comprovação de eficácia e segurança.
“Não existem diferenças clínicas significativas entre biológicos originadores e biossimilares, porque um biossimilar precisa ter equivalência de eficácia e segurança. Portanto, apesar de pequenas diferenças nas moléculas, elas não impactam a ação desses produtos”, garante Dr. Valderílio Azevedo, médico reumatologista, professor adjunto da Universidade Federal do Paraná e coordenador de biotecnologia da Sociedade Brasileira de Reumatologia (SBR).
O especialista esclarece que os biossimilares entregam a mesma resposta clínica que os medicamentos originadores. Além disso, eles podem trazer outros benefícios, como a redução de custos e a ampliação do acesso de pacientes aos tratamentos que necessitam.
“A entrada desses medicamentos quebra a reserva de mercado dos produtos originadores. Com mais concorrência, a tendência é que ocorra redução de preços. Isso é excelente para a população e o sistema de saúde”, afirma o médico.
Segundo dados de 2018 do Instituto de Pesquisa Econômica Aplicada (Ipea), cerca de 60% dos gastos públicos com medicamentos são atribuídos aos chamados componentes especializado e estratégico da assistência farmacêutica, que são medicamentos biológicos em sua grande maioria1. “Com os biossimilares no mercado, o mesmo recurso pode adquirir mais tratamentos”, explica o especialista.
Abaixo, o Dr. Azevedo revela o cenário dos biossimilares no Brasil e no mundo, indicando caminhos para ampliar o uso desses produtos no país. Confira:
Como aconteceu a adoção dos biossimilares no mercado mundial?
Valderílio Azevedo: A regulação dos biossimilares teve início na União Europeia, em 2006, e apenas uma década depois ela ocorreu nos Estados Unidos. Já na América Latina, o Brasil foi o primeiro país a ter uma regulação específica de biossimilares, seguido pelo México e Argentina. Mas hoje todos os países do continente, inclusive os da América Central, já contam com esses produtos. É importante lembrar que à medida que os ambientes regulatórios evoluem, especialmente nos Estados Unidos, China, Japão e países da América Latina, as oportunidades para a adoção dos biossimilares aumentam. E essa é uma questão de economia muito significativa, já que eles custam, em média, 20% a 30% menos que o produto originador. Vale ressaltar que hoje são mais de 60 produtos biossimilares no mercado europeu. No Brasil, são apenas 32 aprovados pela Agência Nacional de Vigilância Sanitária (Anvisa), mas a tendência é que esse número continue a crescer.
Como o senhor avalia a adoção dos biossimilares no mercado brasileiro?
Avalio com bons olhos. Vejo que o Brasil tem um mercado propício para a entrada de biossimilares, especialmente porque eles têm a proposta de reduzir custos em relação aos produtos biológicos originadores, tanto no sistema público quanto no privado. Isso implica a ampliação do acesso a produtos biológicos para pacientes que necessitam, como aqueles com doenças autoimunes crônicas, com doenças neoplásicas e alterações endocrinológicas, como diabetes, bem como aqueles que necessitam de hormônio do crescimento. Esse é o benefício que os biossimilares têm trazido para o mercado brasileiro.
Na sua opinião, quais são as principais barreiras para a adoção dos biossimilares no Brasil?
Acredito que ainda precisamos melhorar a nossa regulamentação, os processos de compra e dispensação, para garantir que as pessoas saibam qual produto estão utilizando [se é originador ou biossimilar], além de conscientizá-las de que o uso dos biossimilares é seguro e eficaz, assim como os originadores. Bem informadas, elas vão perder o receio de utilizá-los. E não há motivo para receio mesmo.
Eles são usados inclusive em pacientes estáveis, no controle da enfermidade, sendo que a troca não oferece risco algum. Aliás, essa substituição já não é mais questão ética, é científica e regulatória, uma vez que os produtos são equivalentes.
Não há dúvida alguma quanto à qualidade dos biossimilares. Há dados suficientes, obtidos por ensaios clínicos publicados em revistas internacionais, que demonstram eficácia e segurança.
Quais doenças podem ser tratadas com biossimilares?
Atualmente, pacientes com patologias diversas podem se beneficiar do tratamento com os biossimilares, entre elas, portadores de doenças crônicas, como diabetes, anemias e doenças autoimunes [artrite reumatoide, espondilite anquilosante e artrite psoriásica]. Também é largamente usado nas doenças inflamatórias intestinais, com destaque para a doença de Crohn e a retocolite ulcerativa. Na oncologia, tem seu uso difundido em algumas neoplasias, como o câncer de mama e o câncer gástrico, e na hematologia, para certos tipos de linfoma. Mas a tendência é que logo surjam biossimilares de outras moléculas, permitindo que possamos tratar diversas doenças com essas drogas, mais acessíveis.
Em outubro, celebra-se o Dia Mundial da Artrite Reumatoide e da Psoríase, doenças que podem ser tratadas com medicamentos biossimilares. Como o senhor avalia o cenário destas doenças depois da chegada dessa classe de medicamentos?
Tanto a artrite reumatoide quanto a psoríase são doenças autoimunes, capazes de diminuir, e muito, a qualidade de vida do paciente. Felizmente, hoje temos medicamentos biológicos que agem diretamente contra intermediários da resposta inflamatória.
A chegada desses medicamentos foi um divisor de águas no tratamento dessas enfermidades, e como os biossimilares são capazes entregar a mesma resposta clínica, é possível tratar um maior número de pacientes. A possibilidade de ampliar a acessibilidade aos tratamentos é fundamental para a população.
Quais são os critérios que o senhor avalia para escolha de um biossimilar?
Todos os biossimilares que entraram no Brasil são de qualidade e não há diferença em relação à eficácia e segurança, quando comparados com as moléculas originadoras. Esse rigor e segurança se devem à Resolução RDC nº 55, de 16 de dezembro de 2010, que trata do registro de biossimilares no país.
Essa foi a primeira regulação dessa classe de medicamentos da América Latina, e garantiu que nenhum produto de má qualidade entre em território nacional. Temos produtos lançados por grandes companhias internacionais, como a Amgen, comprometidas com o desenvolvimento de biossimilares dentro do Brasil.
Qual o seu principal conselho para médicos a respeito do uso e adoção dos biossimilares?
O processo de regulamentação do medicamento biossimilar no Brasil existe desde 2010, sendo que o registro do primeiro biossimilar ocorreu em 2015. Desde então, o número e os estudos científicos com essa classe de medicamento vêm crescendo com grande quantidade de evidências pré-clínicas, clínicas e do mundo real, confirmando qualidade, eficácia e segurança em relação ao medicamento biológico originador. Embora a maioria dos médicos esteja ciente da existência dos medicamentos biossimilares, às vezes podem existir lacunas de conhecimento em relação à eficácia e segurança dessas moléculas, o que pode levar a incertezas quanto ao seu uso na prática clínica diária.
O conhecimento, a compreensão e a percepção do paciente sobre os biossimilares também desempenham um papel importante no que diz respeito à aceitação e aos resultados do tratamento e cabe também ao médico esclarecer e desmistificar possíveis dúvidas existentes. Os pacientes que conhecem os biossimilares tendem a ter percepções mais positivas do que os pacientes que os desconhecem. Portanto, a baixa consciência e os equívocos sobre os medicamentos biossimilares podem criar, ou ampliar, lacunas nas percepções do médico e do paciente, impactando assim o seu uso.
Muitos países encorajam a mudança para a adoção dos biossimilares e essas mudanças, em geral, são lideradas por médicos. Nos mercados europeus, a adoção de biossimilares chega próxima aos 50% em volume em todas as moléculas. Em virtude de um comportamento próprio, no Brasil, além do setor privado, vemos um aumento das compras no SUS.
Pensando na sustentabilidade do sistema, do total investido em medicamentos hoje no Brasil, cerca de 60% são em medicamentos biológicos. Os biossimilares existem porque podem reduzir custos, tanto para os pacientes quanto para todo o sistema de saúde, promovendo assim possibilidades reais de acesso aos pacientes. Portanto, estudem, informem-se sobre os dados e conheçam melhor esses produtos. Com informação, fica evidente a qualidade dos biossimilares e a partir daí, com confiança, lutem para melhorar a regulação interna no Brasil.
Fonte: Exame